Physique-Chimie
Organisation et transformation de la matière en 4ème
En 4ème, l'élève parvient à comprendre ce qu'il voit grâce à ce qui se passe à l'échelle microscopique... Il plonge au coeur de la matière!
Les états de la matière
L'étude de la composition de la matière se poursuit en 4ème.
Elle peut reprendre les concepts vus pour les solides et les étendre aux gaz : la détermination expérimentale de sa composition de l'air ou son approche historique par Lavoisier peut être envisagé.
L'air : de quoi est composé ce mélange de gaz indispensable à notre vie ? Quelles sont ses propriétés ?
Un peu d'histoire des sciences grâce à ce document interactif sur l'expérience de Lavoisier vous permettra de savoir comment on a pu connaître les proportions de dioxygène (20%) et de diazote (80%) contenues dans l'air et de savoir faire définitivement la distinction entre un gaz et une fumée.
Les transformations chimiques
Votre enfant interprète toutes les transformations chimiques qu'il effectue comme étant une façon de redistribuer les atomes (constituants des molécules) des réactifs (ce qui est mis au départ) en formant produits (ce qui est obtenu au terme de la transformation).
Les combustions
Pour brûler, une substance a besoin d'air et plus précisément de dioxygène, c'est d'ailleurs pour cette raison que pour éteindre un incendie, on étouffe la flamme avec un tissu ou de la mousse d'extincteur.
Une expérience simple réalisée en classe montre en effet que la combustion d'un morceau de charbon de bois est beaucoup plus vive dans le dioxygène que dans l'air (car l'air ne contient que 20 % de dioxygène).
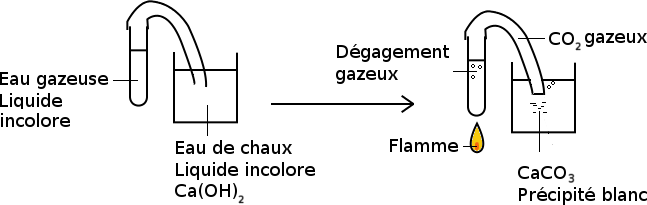
Lors de cette combustion, le charbon de bois (constitué de carbone) et le dioxygène ne disparaissent pas vraiment puisque de l'eau et du dioxyde de carbone se forment (on observe de la buée sur les parois du récipient et le test à l'eau de chaux permettant de détecter la présence de dioxyde de carbone est positif).
L'élève a ainsi réalisé une transformation chimique. La plupart des expériences qu'il avait faites étaient des transformations physiques (changement d'état, compression) puisqu'elles ne changeaient pas la nature des molécules.
Il avait déjà réalisé, sans en être conscient deux autres transformations chimiques en 5ème: le test de détection de l'eau grâce au sulfate de cuivre anhydre et celui de détection du dioxyde de carbone par l'eau de chaux. Dans les deux cas, les molécules initiales et finales sont différentes.
| Test de détection de l'eau | Test de détection du dioxyde de carbone |
|---|---|
|
|
|
L'étude des combustions a aussi pour objectif de sensibiliser les élèves à leur dangerosité : on pense immédiatement aux risques d'incendie mais les élèves doivent être sensibilisés aux risques d'intoxication au monoxyde de carbone.
Il doivent pouvoir comprendre le fonctionnement du triangle du feu, bien connu des pompiers.
Le visionnage de l'épisode de l'émission « C'est pas sorcier » intitulé « Au feu » pourra être très instructif :
Ce qui a lieu lors des transformations chimiques est explicable grâce aux atomes, constituants des molécules, qui se réarrangent.
Pour comprendre ce qui se passe, l'utilisation de modèles moléculaires est indispensable.
Chaque type d'atome est représenté par une sphère colorée différente
- rouge pour l'oxygène,
- noir pour le carbone,
- vert pour le chlore…
Chaque atome a également un symbole
- O pour l'atome d'oxygène,
- N pour l'atome d'azote,
- H pour l'hydrogène,
- C pour le carbone…
L'élève doit savoir construire les molécules, écrire la formule de celles qui sont mises en jeu lors des transformations chimiques étudiées et comprendre un fait important : aucun atome ne disparaît, aucun n'apparaît. Seul leur arrangement change.
Formule H2O pour la molécule d'eau,
CO2 pour celle de dioxyde de carbone…
L'élève est tout à fait capable de l'envisager car, étant petit, il pouvait réaliser, avec le même nombre de legos, une ou plusieurs constructions très différentes, sans en perdre ou en ajouter un seul… Il en est de même pour les transformations chimiques.
Chez vous, vous pouvez vous constituer facilement une boîte d'atomes pour construire des modèles moléculaires : vous avez besoin de cotillons, de peinture rouge, noire, blanche et bleue ainsi que de cure-dents ou allumettes pour les relier.
Rien ne se perd, rien ne se créé, tout se transforme
Antoine Laurent de Lavoisier
Votre enfant le vérifiera en réalisant une dernière transformation chimique sur une balance : il s'agit de l'attaque d'une craie par du vinaigre.
Cette expérience est réalisable à la maison, sur la balance de cuisine, dans un récipient parfaitement hermétique : il suffit de disposer sur la balance allumée, un récipient contenant du vinaigre blanc avec son capuchon, et de poser une craie à côté. Pensez à noter la masse de l'ensemble. Puis, introduisez la craie dans le vinaigre et rebouchez rapidement. Après quelques minutes, la craie est bien attaquée, du gaz s'est produit … mais la masse n'a pas changé.